· Crear cuenta
· Crear cuenta de empresa
· Crear cuenta de sociedad médica
Tratamiento de un paciente oncológico. JUSTIN SULLIVAN (GETTY IMAGES)
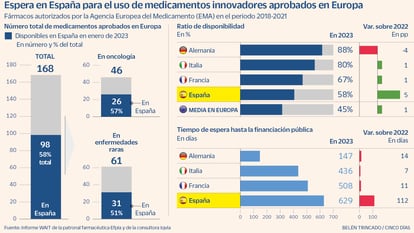
España ha agudizado en el último año el tiempo de demora para que el Sistema Nacional de Salud otorgue la financiación a los tratamientos innovadores autorizados previamente por la Agencia Europea del Medicamento (EMA). En el último año, ese retraso ha aumentado en 112 días, hasta las 629 jornadas de espera, según el reciente informe Wait, de la patronal farmacéutica europea Efpia y la consultora Iqvia. ¿Pero cuáles son esos medicamentos?
Estos fármacos, que en muchos casos son la única opción de tratamiento eficaz para los pacientes, afectan a oncología, enfermedades raras, cardiología... La demora también es relevante para la industria farmacéutica, que ve reducido el periodo de comercialización en exclusividad y protegido por patente. Este diario ha recopilado algunos de los nombres de esas terapias en la base de datos pública Bifimed del Ministerio de Sanidad, con la ayuda de sociedades médicas, de pacientes y empresas farmacéuticas.
El citado informe Wait (Waiting to Access Innovative Therapies o Espera en el acceso a terapias innovadoras, en español) recoge cómo de rápido introducen los países europeos las innovaciones autorizadas para su comercialización por parte de la EMA entre 2018 y 2021. A fecha de enero de 2023, España está a la cola europea en días de espera, muy lejos de los 147 días de Alemania, pero también de otras grandes economías como Francia e Italia (ver gráfico). Sin embargo, ha mejorado ligeramente en la ratio de disponibilidad, ya que el 58% de esos nuevos tratamientos cuentan con financiación pública, cinco puntos más que un año antes.
BELÉN TRINCADO AZNAR
El proceso para que un medicamento llegue a una persona tiene dos etapas principales. Primera: la EMA debe autorizar la terapia después de analizar los ensayos clínicos con pacientes. Después, en España, el Ministerio de Sanidad (en colaboración con las comunidades autónomas) lidera una evaluación para decidir si a ese medicamento se le otorga la financiación pública porque sea un avance para alguna enfermedad respecto a los productos existentes en el mercado. Es el periodo en el que la espera se alarga en exceso en el caso español.
Roberto Saldaña, director de innovación de Eupati España –una academia para pacientes a nivel de la UE y con financiación de la Comisión Europea–, explica que es normal que el Ministerio de Sanidad tome sus propias conclusiones de los medicamentos aprobados en Europa, por las dudas que pueda tener sobre la eficacia de los ensayos. “El retraso no es bueno ni malo. El problema es que no hay herramientas para comparar la eficacia de lo que ya se usa en Alemania”, ejemplifica. Y pone el foco en la clave de la demora: “El problema es presupuestario básicamente y de burocracia”. Lamenta que no se utilicen fórmulas de financiación en colaboración con las farmacéuticas, como el pago por resultados de una nueva terapia, es decir, que el sistema público solo subvenciona si el enfermo tiene una mejoría.
La base de datos recoge ocho fármacos oncológicos aprobados en Europa desde 2019 y que todavía no se utilizan en España. Entre ellos destacan Talzenna y Daurismo (del gigante farmacéutico estadounidense Pfizer), Ayvakyt (de Blueprint) y Phesgo, una combinación de anticuerpos monoclonales fabricada por el laboratorio Roche frente al cáncer de mama. Uno de los casos más conocidos es el de Tecartus (de la biofarmacéutica estadounidense Gilead), que es una de las primeras y costosas terapias celulares de CAR-T aprobadas en Europa.
En el informe Wait se indica que la ratio de disponibilidad de terapias frente al cáncer en España de los medicamentos con luz verde de la EMA es del 57%, ligeramente por encima de la media europea (del 50%), aunque lejos de Alemania, donde en enero de 2023 ya se utilizaban el 100% de los autorizados entre 2018 y 2023.
Uno de los casos de demora, y además con rechazo de financiación, es el de dos tratamientos frente al sarcoma. Y es que otra de las situaciones que se pueden dar es que después de meses de análisis de terapias validadas en Europa, España decida descartar su desembolso en el Sistema Nacional de Salud (y solo sean accesibles para los pacientes si los pagan). Es el caso de Vitrakvi (de la alemana Bayer) y Rozlytrek (de la suiza Roche) para tratar sarcomas. Desde la asociación de pacientes Asarga se denunció a principio de año que esta negativa supone dejar “sin tratamiento alternativo” a estas personas, mientras que países como Italia o Alemania sí lo subvencionan. Asarga protesta contra que solo puedan beneficiarse si pagan alrededor de 5.000 euros al mes de forma privada.
“Sanidad tiene que estar segura de que lo que financia merezca la pena y sea diferenciador. El problema es que hay patologías en las que se están retrasando o negando productos donde no hay alternativa frente a la mortalidad”, advierte Saldaña.
En cáncer de pulmón no microcítico, por ejemplo, Sanidad decidió no financiar Gavreto (de Roche) y Rybrevant (de Janssen), ambos aprobados en Europa en 2021. Y otra terapia, Lumykras (de Amgen) lleva más de un año en estudio sin obtener precio de reembolso.
“A los pacientes se les priva de esa mejora en el tratamiento con sus consecuencias negativas”, denuncia Andoni Lorenzo, presidente del Foro Español de Pacientes.
En patologías poco frecuentes se concentran también gran parte de los retrasos. En este caso, los llamados medicamentos huérfanos van dirigidos a unos escasos pacientes y suelen tener precios muy elevados para compensar la inversión (que puede ascender a cientos de millones de euros) en la I+D de la empresa farmacéutica que desarrolle el medicamento. Por el alto importe, las autoridades sanitarias suelen cerciorarse de que ese producto tengo un verdadero beneficio para la persona atendida. El informe Wait destaca que en España una ratio de disponibilidad del 51% de las 61 terapias aprobadas por la EMA y el tiempo de espera se dispara a 713 días para recibir la financiación pública.
Los datos recopilados indican que hay 16 de estos medicamentos huérfanos aprobados por la UE desde 2018 sin desembolso por las arcas públicas en España. Entre ellos, Koselugo, para la neurofibromatosis, y Stensiq, para la hipofosfatasia (ambas de la compañía británica AstraZeneca) o Hepcludex (de Gilead) frente a la conocida como hepatitis delta.
Juan Carrión, presidente de la Federación Española de Enfermedades Raras (Feder), recuerda que solo el 5% de las 6.172 patologías poco frecuentes tienen tratamiento. “La principal barrera es la escasez”, manifiesta, a la que se suma el bloqueo al acceso de las nuevas a las terapias. “La autorización de un medicamento en Europa no siempre es sinónimo de acceso. En nuestro país están financiados el 43% de los 146 medicamentos huérfanos autorizados en Europa”, se queja.
En cardiología hay actualmente tres medicamentos en espera y que los médicos consideran relevantes. Se trata de Nilendo (de la japonesa Daiichi-Sankyo), Leqvio (del gigante suizo Novartis) y Vazkepa (de la irlandesa Amarin), que pueden evitar episodios graves a personas, por ejemplo, con niveles altos de colesterol.
Luis Rodríguez Padial, presidente electo de la Sociedad Española de Cardiología (SEC), destaca que estas tres moléculas son muy útiles “sobre todo en prevención” para rebajar el colesterol en pacientes con problemas cardiovasculares previos en los que otros fármacos han dejado de ser útiles. “Los estudios del icosapento de etilo [Vazkepa] han demostrado la reducción de la mortalidad de forma significativa. Son tres fármacos importantes y los pacientes podrían beneficiarse claramente”, afirma. “El tema es económico, porque los tres tienen resultados que muestran el beneficio”, denuncia Rodríguez Padial.
Los retrasos en la subvención pública suponen, obviamente, también un problema para las firmas farmacéuticas, ya que ven reducido el tiempo de exclusividad de su patente, de 10 años, lo que provoca que se reduzcan sus retornos para compensar la inversión en I+D.
“Este problema de acceso a los medicamentos innovadores es un diagnóstico compartido entre las autoridades sanitarias, pacientes, profesionales sanitarios e industria farmacéutica y requiere una solución urgente en la que desde Farmaindustria ya estamos trabajando con la Administración”, explica Juan Yermo, director general de Farmaindustria, en la presentación del informe Wait. “La meta es alcanzable, pero requiere una reforma en profundidad”, añade.
El gabinete de prensa del ministro José Manuel Miñones no respondió a varias peticiones de este diario sobre los motivos para el incremento en el retraso de la financiación pública.
“El retraso supone un fracaso del Sistema Nacional de Salud, que no es capaz de manejar los tiempos para su acceso a los pacientes”, incide Lorenzo, del Foro Español de Pacientes.
Fuente: Cinco Días

