· Crear cuenta
· Crear cuenta de empresa
· Crear cuenta de sociedad médica
BELÉN TRINCADO AZNAR
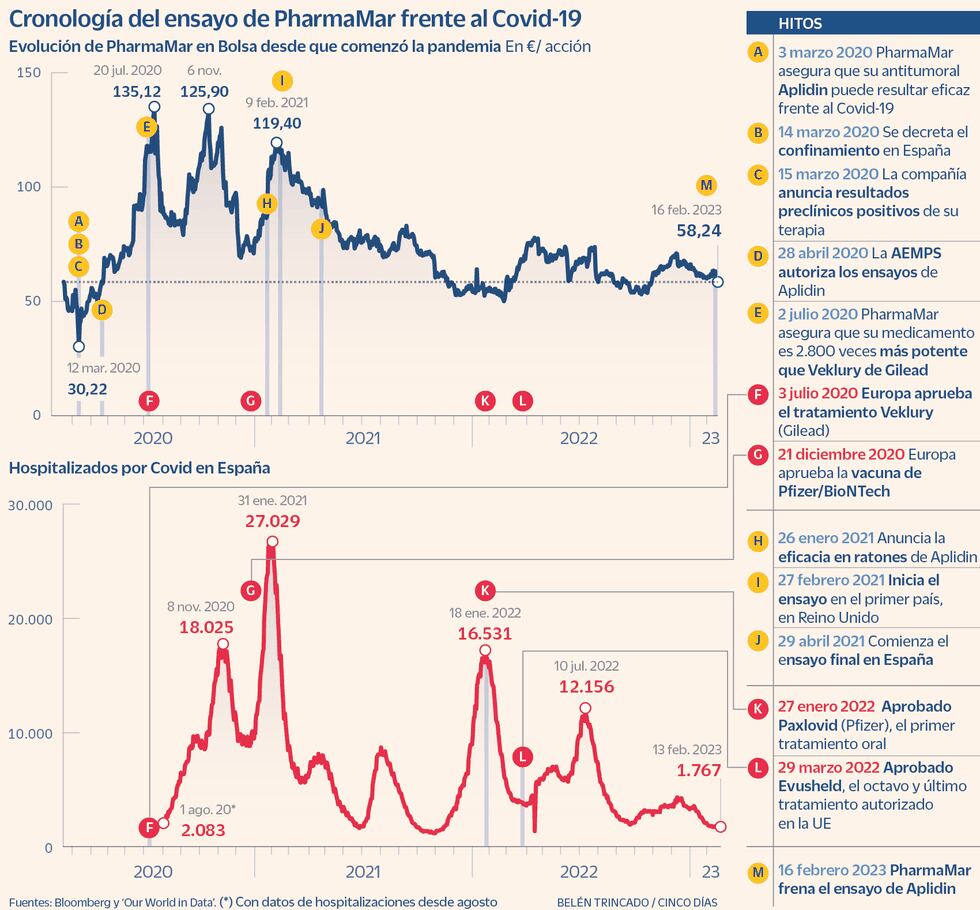
PharmaMar ha parado el estudio de su fármaco experimental contra el Covid-19 “ante la falta de pacientes”, según anunció ayer el laboratorio cotizado. A pesar de ser uno de los primeros medicamentos en anunciarse en el mundo para esta enfermedad, en marzo de 2020, no ha logrado reclutar suficientes personas hospitalizadas, tal como aseguró la empresa en un hecho relevante a la Comisión Nacional del Mercado de Valores (CNMV). En ese periodo, sin embargo, ocho medicamentos han sido aprobados por la Agencia Europea del Medicamento (EMA, en sus siglas en inglés).
La compañía española, presidida por José María Fernández Sousa-Faro, anunció el 15 de marzo de 2020, justo al inicio del confinamiento de Covid-19, que su antitumoral Aplidin (que había sido rechazado como medicamento oncológico por la EMA) daba resultados positivos en estudios preclínicos como antiviral. Como resultado, las acciones del laboratorio se dispararon ese día un 33%.
El 29 de abril de 2020, PharmaMar informó de que iniciaba los ensayos con pacientes tras recibir el visto bueno de la Agencia Española de Medicamentos y Productos Sanitarios (Aemps). En ese momento no había ningún fármaco en el mundo aprobado para hacer frente a la pandemia.
El primer tratamiento en aprobarse en Europa fue Veklury (de Gilead), un fármaco que, igual que en el caso de Aplidin, el laboratorio estadounidense reutilizó como antiviral frente al SARS-CoV-2. Fue en julio de 2020 y PharmaMar comunicó justo en esas fechas que su medicamento experimental era hasta 2.800 veces más potente.
Ese verano, PharmaMar consiguió marcar el máximo en Bolsa de los últimos tres años. La cotización de la compañía logró dispararse un 195% respecto a inicios de marzo de 2020, antes del anuncio de ensayos clínicos para reconvertir Aplidin en un antiviral frente al SARS-CoV-2. Ese impulso sirvió para que la empresa entrase en el Ibex 35 a finales de 2020. Desde esa noticia, el precio de las acciones de la compañía ha mejorado casi un 28%. El laboratorio se dejó ayer un 2,38% tras informar del cierre del reclutamiento de pacientes.
En octubre de 2020, el laboratorio madrileño, cuya actividad es la comercialización de tres antitumorales, anunció resultados positivos de los primeros ensayos, en lo referente a la seguridad del compuesto.
En noviembre, la CNMV, en un caso nada habitual, pidió explicaciones a la empresa sobre los resultados positivos que había anunciado el mes anterior. La sociedad tuvo que responder a un requerimiento del supervisor en el que urgía una aclaración. La empresa de origen gallego (la antigua Zeltia) admitió que las pruebas realizadas con este medicamento no eran suficientes para concluir su eficacia, ya que hasta entonces solo se había realizado la fase I y II, donde se prueba únicamente la seguridad.
Finalmente, la compañía inició el ensayo en fase III en febrero de 2021 en Reino Unido. Y dos meses más tarde se unió España. Hasta el día de ayer, no había comunicado ningún tipo de avance ni actualización.
El estudio en fase III –la prueba de eficacia necesaria para recibir la autorización de comercialización– se planteó en 98 centros para captar 609 pacientes. Participaron hospitales de Argentina, Brasil, Bulgaria, Colombia, Francia, Grecia, México, Perú, Portugal, Rumanía, Sudáfrica y España. Un portavoz de la empresa indica que solo han conseguido reclutar alrededor de un tercio de las personas hospitalizadas necesarias. “La compañía ha tomado esta decisión ante la falta de pacientes para el reclutamiento del estudio debido a la evolución de la pandemia”, indica la empresa en la información remitida a la CNMV. Los datos de la Aemps muestran que en España PharmaMar ha realizado el ensayo en 36 hospitales. La investigación se centró en infección por Covid-19 de carácter moderado.
Un portavoz de la compañía indica que debido al avance de la vacunación y, por tanto, a un menor número de pacientes ingresados, ha sido imposible reclutar al número de hospitalizados exigidos. No obstante, desde febrero de 2021 que inició los ensayos en fase III, se vivieron dos olas de hospitalizaciones, en verano de 2021 y en enero de 2022 (con la aparición de la variante ómicron). Desde esta empresa se indica que no pueden responder a por qué los médicos de todos los países en los que se probó no reclutaron más pacientes para administrarles Aplidin.
Los problemas esgrimidos por el laboratorio no han supuesto una barrera para otras compañías, que avanzaron mucho más rápido que la firma de Fernández Sousa-Faro. Desde que PharmaMar anunciara el inicio de los últimos estudios clínicos, la EMA ha validado Ronapreve (noviembre de 2021), Regkirona (noviembre de 2021), Xevudy (diciembre de 2021), Roactemra (diciembre de 2021), Kineret (diciembre de 2021) y Evusheld (marzo de 2022). Además, en enero del pasado año dio luz verde a las primeras píldoras frente a la enfermedad, un tratamiento llamado Paxlovid, de Pfizer, que se ha convertido en un medicamento superventas con 18.933 millones de dólares en facturación en 2022.
La empresa asegura “una tendencia positiva demostrando la potente actividad del fármaco”
No hay que olvidar que todas las autoridades sanitarias fueron en 2020, 2021 y 2022 diligentes y rápidas en evaluar (y aprobar si un medicamento aportaba eficacia) las posibles terapias ante la emergencia mundial causada por la pandemia de Covid-19 y su consecuente mortalidad, confinamiento y crisis económica.
El laboratorio reconoce que la aprobación de otros tratamientos también ha sido una razón que ha hecho mermar la opción de reclutar pacientes, ya que los médicos podrían apostar por tratamientos autorizados frente a uno experimental.
Aun así, la compañía asegura en el comunicado de ayer que un análisis preliminar sugiere “una tendencia positiva demostrando la potente actividad del fármaco”. Pero apunta a que esos datos se conocerán en una “posterior publicación”, que bien podría ser en una revista o en un congreso científico.
Fuente: Cinco Días

