· Crear cuenta
· Crear cuenta de empresa
· Crear cuenta de sociedad médica
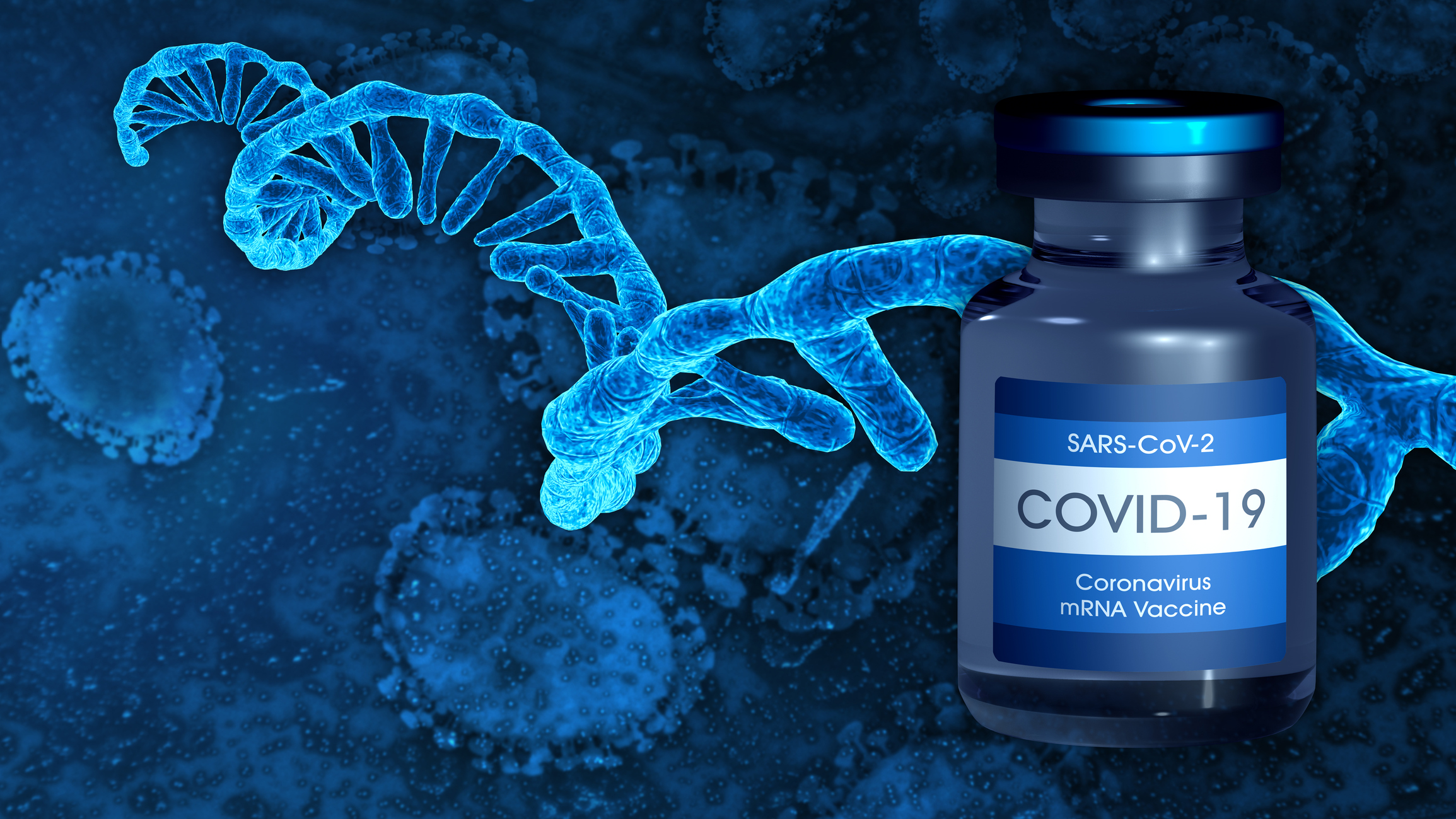
La Agencia Europea del Medicamento (EMA) organizó el pasado 8 de enero su segunda reunión pública para informar a la población general de las bases sobre la aprobación y el uso de las vacunas de ARN mensajero (ARNm) contra la COVID-19.
A diferencia de la primera reunión, que tuvo lugar a principios de diciembre de 2020, en esta ocasión ya había dos vacunas de este tipo sobre la mesa: la vacuna Comirnaty (Pfizer/BioNTech) y la vacuna de Moderna, ya autorizadas y comercializadas en la Unión Europea.
Por ello, Emer Cooke, directora ejecutiva de la EMA, explicó que el objeto de esta segunda reunión era la actualización sobre la aprobación de la evaluación y el lanzamiento de las nuevas vacunas COVID-19.
“Hemos trabajado junto a la Comisión Europea a contrarreloj para evaluar, aprobar y distribuir las vacunas COVID-19 entre la población europea lo más rápido posible, pero al mismo tiempo, asegurándonos de que se cumplen los mismos requisitos de seguridad, calidad y eficacia que esperaríamos de cualquier vacuna“, señaló Cooke.
Harold Enzmann, del Comité de Medicamentos de Uso Humano (CHMP) de la EMA explicó el funcionamiento de las vacunas de ARNm, que preparan al cuerpo para defenderse contra la COVID-19.
“El ARN mensajero tiene instrucciones para producir la proteína del pico, necesaria para que el virus entre en las células del cuerpo. Cuando a una persona se le administra la vacuna, algunas de sus células ‘leen’ las instrucciones del ARNm y, temporalmente, produce la proteína del pico”, ha señalado Enzmann.
Tras ello, el sistema inmunitario de la persona reconoce la proteína como desconocida y produce anticuerpos y leucocitos para atacarla. “Si, de ahí en adelante, la persona entra en contacto con el virus del SARS-CoV-2, su sistema inmunitario lo reconocerá y estará preparado para defender el cuerpo de ello”, afirmó el experto.
Además, Enzmann añadió que el ARNm de la vacuna no permanece en el cuerpo, sino que se “descompone” en poco tiempo tras la vacunación.
En definitiva y, a diferencia de otras vacunas que contienen una variante inofensiva del virus o partes de él, estas nuevas vacunas de ARNm no contienen el virus, sino que únicamente llevan el ARN mensajero para producir la proteína del pico. “Solo contienen el plan sobre cómo hacer estas características del virus, contienen las instrucciones para producir la proteína del pico. Serán nuestras propias células quienes traduzcan el ARNm”, argumenta Enzmann.
Las dos vacunas aprobadas en la UE, han mostrado una alta eficacia. Y los estudios así lo han demostrado. La vacuna Comirnaty tiene un 95 por ciento de eficacia, mientras que la vacuna de Moderna tiene un 94,1 por ciento.
Por cada 10.000 participantes que recibieron la vacuna, esto fue lo que pasó comparado con aquellos que recibieron placebo: 84 casos de COVID-19 con síntomas fueron previsibles por la vacuna (95 por ciento de todos los casos); 4 casos de COVID-19 con síntomas ocurrieron a pesar de la vacuna (5 por ciento de todos los casos); y 9.912 participantes no tuvieron síntomas de COVID-19.
A pesar de estos datos tan positivos, no se pueden descartar efectos secundarios. Sin embargo, en la mayoría de casos prevalecen los efectos leves o moderados sobre los graves, y desaparecen en unos pocos días. Por tanto, tienen una alta eficacia considerando la situación de gravedad de la pandemia.
Se debe tener en cuenta que ninguna de estas dos vacunas están actualmente aprobadas para niños. De hecho, Comirnaty solo puede administrarse a mayores de 16 años y la vacuna de Moderna, a mayores de 18.
Por otro lado, los datos que se tienen sobre mujeres embarazadas en los ensayos clínicos de ambas vacunas, son muy limitados. De este modo, los expertos recomiendan que la decisión sobre usar la vacuna o no en mujeres embarazadas se tome junto a un profesional de la salud después de considerar los beneficios y los riesgos.
La EMA decidió finalmente autorizar estas dos vacunas en la UE porque los beneficios son mayores que los riesgos. Aún así, se realizará un seguimiento estrecho de estas dos vacunas durante los próximos dos años, tiempo en el que las compañías deberán seguir aportando más datos.
Sabine Straus, presidenta del Comité Europeo de Farmacovigilancia (PRAC) aseguró que el monitoreo de la seguridad tras su aprobación es “necesario para detectar cualquier novedad o cambio en los efectos secundarios”.
¿Y cómo garantizar el mantenimiento de la monitorización de la seguridad de las vacunas una vez aprobadas y distribuidas? La presidenta del PRAC respondió que se realizará a través de:
Fuente: El Global

