· Crear cuenta
· Crear cuenta de empresa
· Crear cuenta de sociedad médica
Un investigador sostiene una vacuna experimental en las instalaciones de Sinovac Biotech, en China - AFP
La Comisión Europea ha firmado cinco acuerdos con compañías farmacéuticas para comprar cientos de millones de dosis de vacunas, en caso de que prueben su eficacia y su seguridad y sean aprobadas por la Agencia Europea de Medicamentos (EMA). En ese caso, cada estado miembro tendría acceso a adquirir una cantidad de dosis proporcional a su población (a España le corresponde cerca del 10% de lo acordado por Bruselas).
El ejecutivo comunitario ha seleccionado una serie de vacunas experimentales en base a muy diversos criterios, como el coste, la velocidad de producción y distribución, la fiabilidad de la plataforma en la que se basa cada vacuna o la capacidad de suministrar viales a toda la Unión Europea, entre otras cosas.
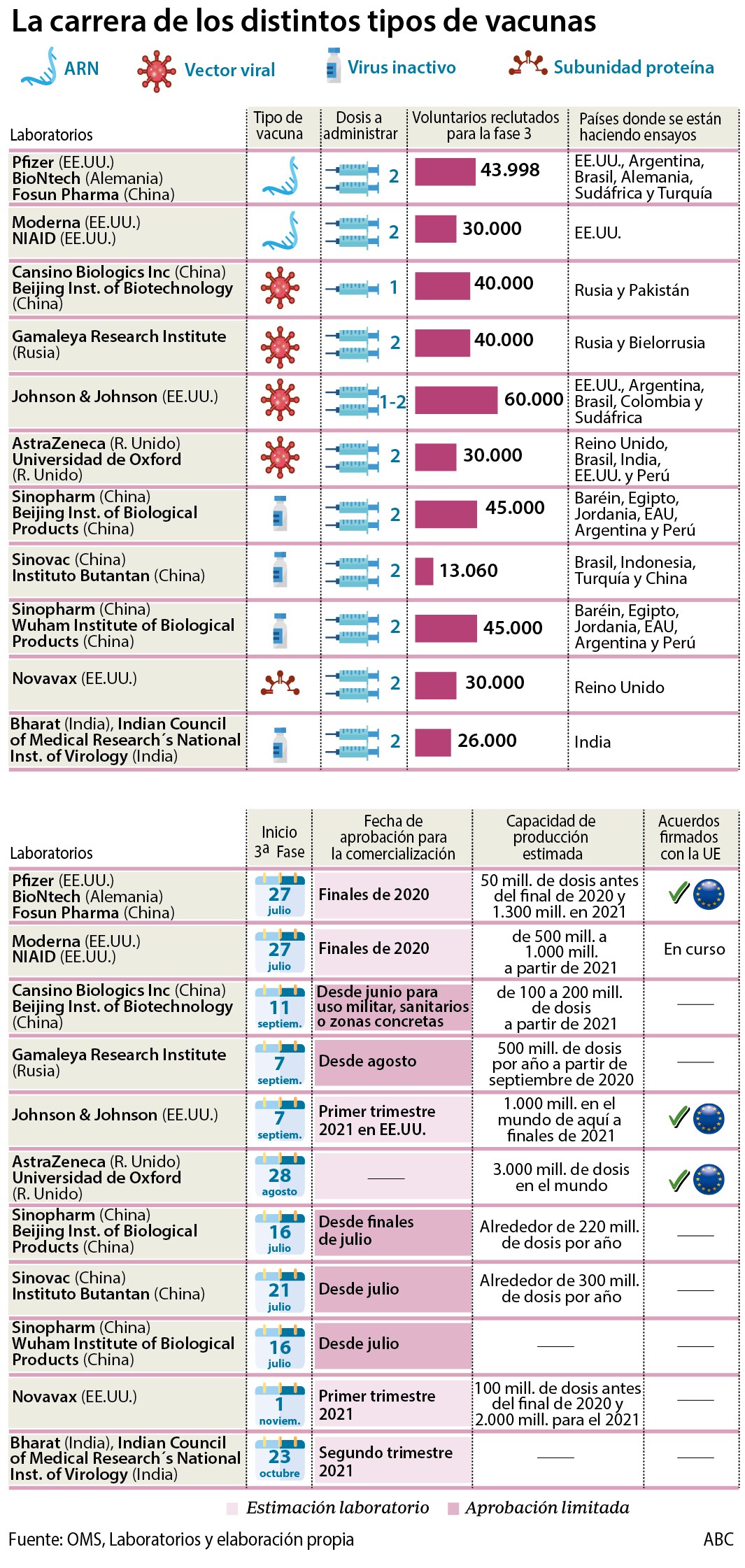
A falta de saber cuáles serán las vacunas más efectivas y seguras, y cuánto dura la protección que confieren, Europa ha optado por tener al alcance un repertorio amplio de fármacos, basados en diferentes tecnologías. Además, a través de estos acuerdos, la Comisión Europea busca potenciar la investigación de las vacunas.
Hasta ahora, Bruselas ha establecido cinco acuerdos con compañías farmacéuticas para adquirir cientos de millones de dosis de vacuna. Un sexto, con la compañía Moderna, se podría cerrar próximamente:
-Pfizer/BioNTech (fármaco en fase III): 200 millones con opción a 100 millones más. Este fármaco se basa en tecnología experimental de ácido nucleico mensajero (ARNm), que introduce instrucciones en las células para que produzcan una proteína del SARS-CoV-2 que «enseñe» al sistema inmunitario a reconocer al virus. Este tipo de vacuna es fácil y rápido de producir pero requiere temperaturas de conservación muy bajas, de -80ºC, lo que dificulta las cadenas logísticas. El de Pfizer y BioNTech ha sido el primer candidato a vacuna en obtener resultados de eficacia, alcanzando además cifras del 90%, según estudios preliminares. Requiere dos dosis y la autorización de la FDA, en Estados Unidos, se espera para finales de 2020.
-Astrazeneca/Universidad de Oxford (en fase III): 300 millones de dosis con opción a 100 millones más. Este fármaco se basa en la tecnología de los vectores virales. Emplea un adenovirus de chimpancé para introducir una proteína del SARS-CoV-2, que es reconocida por el sistema inmunitario. Es más difícil de producir pero más fácil de conservar que las de ARN. Requiere dos dosis. La compañía tiene capacidad para producir 2.000 millones de dosis en un año, y se esperan los resultados de eficacia para finales de 2020. En septiembre un voluntario desarrolló mielitis y los ensayos se detuvieron temporalmente.
-Sanofi/GSK (en fase II): 300 millones de dosis. Ambas compañías tienen en marcha una vacuna basada en subunidades proteicas. Producen proteínas del SARS-CoV-2 dentro de células de insectos, las suplementan con adyuvantes, para activar al sistema inmunitario, y las inyectan. Esta tecnología es la misma que se usa en la vacuna Flublok, de Sanofi, y aprobada para la gripe. Esperan comenzar la fase III de sus estudios en diciembre y recibir la autorización de la EMA en junio de 2021, año en el que esperan poder producir 1.000 millones de dosis.
-Johnson & Johnson (en fase III): 200 millones más 200 millones adicionales. La vacuna se basa en el adenovirus 26, una plataforma también empleada en una vacuna aprobada frente al ébola, y en candidatos a vacuna frente al zika, el virus respiratorio sincitial y el VIH. La tecnología usada, la experiencia en el desarrollo de vacunas y la capacidad de producción han llevado a la UE a apostar por este candidato. La compañía espera producir al menos 1.000 millones de dosis en 2021, y tener listos los resultados de la fase III a finales de este año.
-CureVac (en fase II): 405 millones de dosis. Este candidato a vacuna se basa en el ARNm, que se introduce en el organismo en el interior de nanopartículas de lípidos. Requiere dos dosis. La compañía espera comenzar la fase III a finales de 2020 y producir para entonces alrededor de 100 millones de dosis. A diferencia de la vacuna de Pfizer/BioNTech, la de CureVac puede conservarse en una nevera, según la compañía.
-Próximamente, Moderna (en fase III): 80 millones más 80 millones adicionales. La compañía estadounidense, con el apoyo de los Institutos Nacionales de Salud (NIH) de Estados Unidos, desarrolla una vacuna basada en el ARNm que se puede conservar a -20ºC, a largo plazo, o durante 30 días en una nevera. Este lunes Moderna ha informado de que tiene una eficacia del 94,5% en estudios preliminares, y parece proteger de la enfermedad severa. La compañía espera poder solicitar la aprobación en las próximas semanas. Requiere dos dosis.
España tiene derecho a 20 millones de dosis de Pfizer/BioNTech, 30 millones de Astrazeneca, 30 millones de Sanofi/GSK, 20 millones de Johnson & Johnson y 40,5 millones de CureVac. De Moderna recibiría 8 millones, si se confirma lo establecido en el acuerdo preliminar.
Fuente: ABC

