· Create user account
· Create company account
· Create medical association account

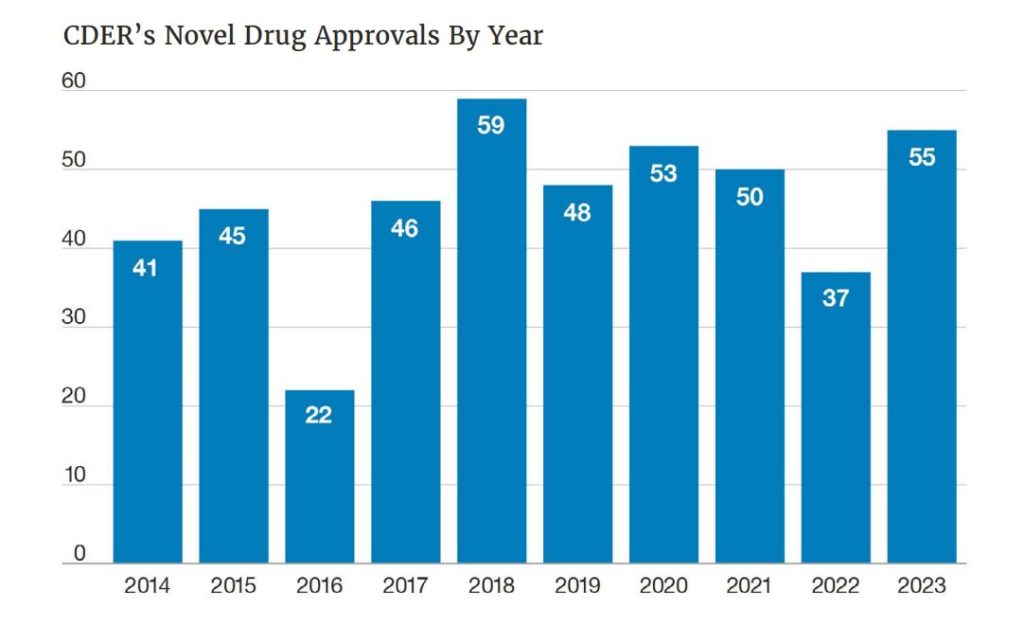
Estados Unidos hace balance de las nuevas aprobaciones de medicamentos llevadas a cabo durante 2023. En este sentido, el Centro de Evaluación e Investigación del Medicamento (CDER, por sus siglas en inglés) de la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) aprobó un total de 55 fármacos basados en nuevos principios activos el pasado año, un 48 por ciento más que en 2022. Así se desprende del balance anual elaborado por el organismo regulador americano, donde se precisa que el 64 por ciento de ellos se aprobaron por primera vez en Estados Unidos antes que en otros países.
Entre las aprobaciones destacan tratamientos para enfermedades infecciosas, incluidos la COVID-19, el virus respiratorio sincitial (VRS) y el VIH; para afecciones neurológicas, como la esclerosis lateral amiotrófica (ELA), la enfermedad de Alzheimer y la migraña; para la diabetes tipo 2 en niños; distintos tipos de anemia y el control crónico del peso, entre otros fármacos para trastornos cardíacos, sanguíneos, renales y endocrinos. “Estas aprobaciones, que dan cobertura a una amplia gama de enfermedades y estados de salud, tienen como objetivo ayudar a muchas personas a vivir mejor y lograr una mayor esperanza de vida”, explica la FDA.
Del total de terapias autorizadas, el 51 por ciento (28 de 55) recibió la designación de medicamento huérfano, ya que se dirigen a prevenir, diagnosticar o tratar una enfermedad rara. En el listado destacan las aprobadas para ataxia de Friedreich, una enfermedad hereditaria y degenerativa que daña el sistema nervioso; candidemia y candidiasis invasiva, infecciones fúngicas graves y potencialmente mortales; síndrome de Rett, un trastorno neurológico genético que afecta al desarrollo del cerebro; enteropatía perdedora de proteínas por deficiencia de CD55 (enfermedad de CHAPLE), una enfermedad genética que afecta al sistema inmunitario; hemoglobinuria paroxística nocturna, una enfermedad que provoca la rotura de los glóbulos rojos; síndrome de la fosfoinositida 3-quinasa delta activada, un trastorno genético que deteriora el sistema inmunitario.
Otros de los datos destacados en el documento es que el CDER identificó el 36 por ciento de los nuevos medicamentos como primeros en su clase (first-in-class). En el listado figuran fármacos como Jesduvroq (daprodustat, GSK); Daybue (trofinetide, Acadia Pharmaceuticals); Fabhalta (iptacopan, Novartis); Ogsiveo (nirogacestat, SpringWorks); Paxlovid (nirmatrelvir y ritonavir, Pfizer); Talvey (talquetamab, Janssen); o Veozah (fezolinetant, Astellas).
En 2023, 31 de los 55 nuevos medicamentos aprobados (56 por ciento) fueron designados de Revisión Prioritaria. Un medicamento recibe esta clasificación si el CDER determina que trata una afección grave y que, de ser aprobado, proporcionaría una mejora significativa en la seguridad o eficacia del tratamiento, diagnóstico o prevención de la afección grave. En términos generales, una solicitud de revisión prioritaria es aquella sobre la que el CDER pretende actuar en un plazo de seis meses a partir de su presentación. Por otra parte, un 65 por ciento de ellos se acogieron a la designación de vía rápida con el objetivo de acelerar su llegada a los pacientes.
En los últimos diez años, la agencia americana ha aprobado 46 nuevos tratamientos de media cada ejercicio y estas 55 aprobaciones se han convertido en la segunda cifra más alta de la década. “Disponer de más y mejores tratamientos tiene un impacto directo en la sociedad en su conjunto, porque además de curar y controlar enfermedades, reducir los síntomas y mejorar la calidad de vida de los pacientes, potencian la eficacia y eficiencia del sistema sanitario, permiten una mayor productividad laboral y generan una importante contribución a la economía nacional”, recuerda la directora del Departamento de Acceso de Farmaindustria, Isabel Pineros.
En este sentido, la gran mayoría de estos nuevos medicamentos aún no han llegado a la región europea, en buena medida debido al tamaño del mercado estadounidense, a la receptividad de la innovación y a la agilidad de los procedimientos de la FDA frente a los de la Agencia Europea de Medicamentos (EMA). “Es fundamental que la reforma de la legislación farmacéutica europea incluya incentivos a la innovación que mejoren el atractivo de Europa para las compañías, que la EMA sea más ágil en sus procedimientos y crear las condiciones para que las empresas decidan invertir en investigación, desarrollo y fabricación en Europa”, indican desde Farmaindustria.
“Las aprobaciones de la FDA demuestran que el trabajo de nuestras compañías por seguir innovando no cesa y que se abren nuevas esperanzas de tratamiento para muchos pacientes y sus familias en numerosas áreas terapéuticas, muchas de ellas hasta ahora sin respuesta. Sin duda, son las mejores noticias para que nuestra sociedad pueda seguir avanzando”, concluye la directora del Departamento de Acceso de Farmaindustria.
Fuente: El Global

