· Create user account
· Create company account
· Create medical association account

El problema de suministro de medicamentos sigue estancado y afectado a aproximadamente un 4% de las presentaciones totales. El último informe de la Agencia Española de Medicamentos y Productos Sanitarios (Aemps), correspondiente al primer semestre de 2024 indica que de 1.415 presentaciones afectadas en los últimos seis meses de 2023, se ha pasado a 1.412, en la primera mitad del presente año. Por segunda vez consecutiva desde 2020, al menos no aumentan.
Según el informe de la Aemps número de presentaciones con problemas de suministro supone el 4% del total de las 32.986 presentaciones autorizadas en España, de un total de 15.443 fármacos. En su gran mayoría, asegura la Agencia, “estas faltas no tenían repercusión en el tratamiento del paciente por ser de corta duración o contar en el mercado con otro medicamento comercializado con el mismo principio activo y la misma vía de administración”.
En el caso de los problemas de suministro que no tienen una alternativa terapéutica disponible, el porcentaje ha descendido ligeramente respecto al segundo semestre de 2023, suponiendo un 0,33% del total de las presentaciones autorizadas. “Una tendencia bajista registrada en los últimos dos semestres que contrasta con el aumento que sufrieron los problemas de suministro de impacto mayor en el primer semestre de 2023”. En los seis primeros meses del pasado año la falta de medicamentos afectó a un 0,48% de las presentaciones de medicamentos (159 en el primer semestre de 2023, frente a 115 en el segundo semestre de 2023 y 109 en el semestre actual).
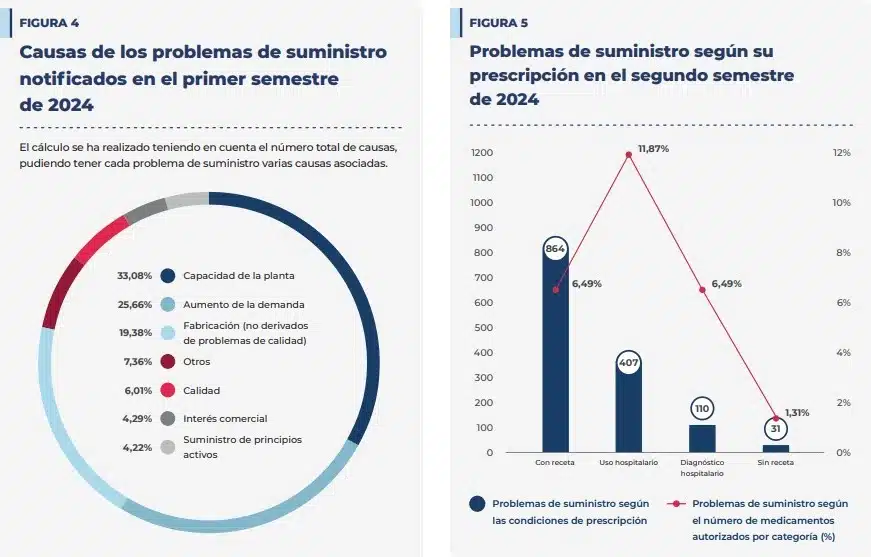
Las principales causas que motivan los problemas de suministro ocasionados durante el segundo semestre de 2023 han sido los problemas de capacidad de la planta, con el 33,08% de los casos; el aumento de la demanda, con el 25,66% y los problemas de fabricación no derivados de problemas de calidad, con el 19,39% del total de las notificaciones.
La Aemps indica que ha incrementado un 22% las acciones que lleva a cabo a nivel nacional para prevenir y mitigar estos problemas, con un total de 866 intervenciones, frente a las 710 de segundo semestre de 2023 y las 546 del primer semestre de 2023.
Entre otros la Agencia destaca las paradas de exportación a países de la UE, 169 frente a las 64 que se ejecutaron en el semestre anterior. “Esto se debe a que en base a la normativa vigente, la Aemps puede limitar la salida del territorio nacional de medicamentos con problemas de suministro y ordenar que esas unidades se destinen a cubrir las necesidades del mercado español”.
La autorización de comercialización excepcional de medicamentos también ha aumentado. De 206 autorizaciones en el primer trimestre de 2024 a 296 en el anterior, lo que supone que, con el objetivo de paliar un problema de suministro, la Aemps ha autorizado la puesta en el mercado de un medicamento igual al autorizado en España, pero acondicionado para otros países y, por ello, etiquetado en otro idioma. Asimismo, la Agencia ha iniciado durante este semestre dos expedientes sancionadores a los titulares de autorización de comercialización por cesar el suministro de ciertos medicamentos. Entre otras acciones, en este semestre ha sido necesario que la Aemps autorice la importación de 29 medicamentos extranjeros.
Principales problemas
Durante el primer semestre de 2024, se han producido algunos problemas de suministro que han hecho que sea necesario que la Aemps tome medidas excepcionales para garantizar la continuidad de tratamientos de los pacientes, destacando cuatro.
Antineoplásicos: cisplatino, carboplatino y 5-fluorouracilo Cisplatino Pfizer notificó a la AEMPS problemas de suministro de Cisplatino Pharmacia 1 mg/ml concentrado para solución para perfusión por problemas de calidad en su planta de fabricación a nivel global. Este problema se resolvió pero, sumado a un traslado de la planta de fabricación a Melbourne, supuso un retraso en la liberación de lotes para su distribución.
Asimismo, Accord Healthcare comunicó que sufriría problemas de suministro de Cisplatino Accord 1 mg/ml concentrado para solución para perfusión debido a restricciones en la capacidad de su planta de fabricación. Como consecuencia, aumentó la demanda de la otra alternativa comercializada en España, Cisplatino Hikma 1 mg/ml concentrado para solución para perfusión, por lo que Hikma Farmacéutica también notificó un problema de suministro al no poder hacer frente a todas las peticiones. Ante esa situación, y como se ha indicado anteriormente, la Aemps junto con algunas sociedades científicas, elaboraron una serie de recomendaciones.
Con el objetivo de minimizar el impacto de la escasez de cisplatino en España, la Agencia importó medicación extranjera, emitió autorizaciones de comercialización excepcional y activó el mecanismo de solidaridad de la UE para recibir unidades de este medicamento.
Actualmente sigue habiendo tensión en el suministro de algunas presentaciones, pero la Aemps y los titulares de autorización de comercialización están trabajando conjuntamente para asegurar el suministro al mercado nacional.
Debido a la situación de escasez de cisplatino, algunos de los medicamentos que contienen carboplatino vieron agravada su situación mientras que otros, entraron en problema de suministro al ser la alternativa disponible para cubrir la falta de cisplatino. La Aemps gestionó la importación de medicamento extranjero y la autoriza[1]ción de comercialización excepcional de unidades de carboplatino para paliar la situación que actualmente está controlada. No obstante, la Agencia, junto a los titulares de autorización de comercialización, sigue haciendo un segui[1]miento estrecho de la disponibilidad de unidades.
Estos problemas de suministro se suman a los ya existentes con el medicamento Fluorouracilo Accord 50 mg/ml solución inyectable para perfusión, que se extienden desde el segundo trimestre de 2023, y que se derivan, al igual que carboplatino y cisplatino, de problemas de capacidad en las líneas de fabricación de medicamentos oncológicos. En la actualidad hay disponibilidad de producto nacional, pero es limitado, por lo que Accord Healthcare S.L.U está realizando una distribución controlada de las unidades, a fin de garantizar el acceso al tratamiento a todos los pacientes.
Kreon 35.000 U cápsulas duras gastrorresistentes, Kreon 25.000 U cápsulas duras gastrorresistentes y Kreon 10.000 U cápsulas duras gastrorresistente. Durante el primer semestre de 2024, Viatris Pharmaceuticals, representante local del titular Viatris Healthcare Limited, comunicó a la Aemps problemas de suministro de estos tres medicamentos en toda la UE debido a problemas de capacidad de la planta de fabricación y a un aumento de la demanda. Estos medicamentos, que contienen proteasa, lipasa y amilasa, están indicados en el tratamiento de la insuficiencia pancreática exocrina.
Ante esta situación, la Agencia ha incluido estas presentaciones en la Circular 2 /2012 para que el TAC notifique previamente el envíos de estos medicamentos a otros Estados miembros y está gestionando la importación de medicación extranjera para aquellos pacientes que no lo encuentren en las oficinas de farmacia.
Insulinas rápidas: Durante el primer semestre de 2024 han continuado los problemas de suministro con Fiasp 100 unidades/ml Flextouch solución inyectable en pluma precargada, 5 plumas precargadas de 3ml y se han notificado dos nuevos problemas de suministro con Novorapid Flexpen 100 u/ml solución inyectable en una pluma precargada, 5 plumas precargadas de 3 ml, y con Novorapid Penfill 100 u/ml solución inyectable en cartucho, 5 cartuchos de 3 ml.
Novo Nordisk Pharma, titular de autorización de la comercialización de estos medicamentos, afirma haber detectado, de manera general, una tendencia del aumento de la demanda en el mercado de las insulinas rápidas. El motivo del aumento inesperado podría estar relacionado con la adopción generalizada de nuevas tecnologías en el control de la diabetes.
Ya que el problema afecta tambien a otros países de la UE, la Aemps ha incluido estas presentaciones en la Circular 2 /2012. La Agencia también se reunió durante el mes de junio con asociaciones de pacientes y sociedades médicas, quienes avanzaron que el consumo de este tipo de medicamentos va a aumentar considerablemente en los próximos años. Ante la preocupación por el aumento en los datos de consumo que la fabricación actual de los medicamentos no cubre, se va a constituir un grupo de trabajo para priorizar su uso.
Durante el primer semestre de 2024, han continuado los problemas de suministro con los medicamentos análogos de GLP-1. Entre los medicamentos afectados se encuentran Ozempic 0,25 mg solución inyectable en pluma pre[1]cargada, pluma precargada de 1,5 ml; Ozempic 0,5 mg solución inyectable en pluma precargada, pluma precargada de 1,5 ml; Ozempic 1 mg solución inyectable en pluma precargada, 1 pluma precargada de 3 ml; Trulicity 0,75 mg solución inyectable en pluma precargada, 4 plumas precargadas; Trulicity 1,5 mg solución inyectable en pluma precargada, 4 plumas precargadas y Victoza 6 mg/ml solución inyectable en pluma precargada, 2 plumas precargadas de 3 ml. Estos medicamentos están autorizados para mejorar el control glucémico en el tratamiento de adultos con diabetes mellitus tipo 2 (DM2) no suficientemente controlada con dieta y ejercicio.
La Aemps, en abril de 2024, publicó una nota informativa en la que se actualizaba la situación de estos medicamentos e informaba de que continuaba realizando un estrecho seguimiento de la escasez de los mencionados medicamentos, debido a que los pacientes con diabetes tipo 2 se siguen viendo afectados por estos problemas de suministro. Por ello, lo que la Agencia subrayaba la importancia de prescribir estos medicamentos solo a los pacientes con diabetes, ya que se han detectado casos de prescripción para indicaciones no incluidas en la ficha técnica.
Fuente: Diario Farma

